Tényleg tartani kell a HBVaxPro hepatitis B elleni vakcinától, mert a tudósok soha nem végeztek biztonságossági teszteket rajta? Nem, ez nem igaz: Az Európai Gyógyszerügynökség (EMA) azért adta meg az HBVaxPro forgalomba hozatali engedélyét anélkül, hogy átmenne klinikai kísérleteken, mert ez egy rég jóváhagyott vakcinának a korszerűsítése egy esetleg veszélyes tartósítószer eltávolításával. Egy orvosi szakértő azt mondta a Lead Storiesnak, hogy a tartósítószer leváltása nem teremtett egyértelmű okot egy új tesztkör lefolytatására.
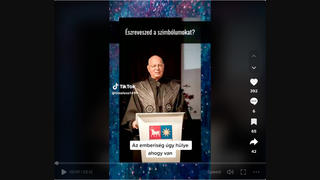
Az állítás egy videóban (archiválva itt) jelent meg 2024. augusztus 31-én az "ISKOLAI KAMPÁNYOLTÁSOK" címmel. A felvételen Dr. Mihalik Angelika ügyvéd beszél, aki tanácsokat ad a szülőknek, hogyan mentesítsék gyermekeiket a kötelező kampányoltás-program alól (itt archiválva). A következőt mondja a 0:53-nál:
A hepatitis B elleni oltóanyagnak a neve - egy új oltóanyag, ezt most szeptembertől alkalmazzák - HBVVaxPro [helyesen HBVaxPro]. A HBVVaxProról azt kell hogy tudjad, hogy úgy került engedélyeztetésre, úgy került forgalomba hozatalra, egy úgy került a magyar oltási rendbe is be, hogy ennek az oltóanyagnak nem voltak biztonságossági vizsgálatai. Nem voltak vizsgálatai. Jól hallod. Tehát az a lényeg, hogy ezt az oltóanyagot élőlényen nem tesztelték. Sem egéren, sem nyúlon, sem patkányon, sem emberen... Tehát fogalmuk nincsen, hogy a te gyerekedre hogyan fog ez az oltás hatni, mert nem végeztek kísérleteket.
A bejegyzés így nézett ki a TikTokon e cikk megírásakor:
(Forrás: TikTok képernyőmentés. Készült: 2024. december 9., hétfő, 9:09:47 CET)
Az HBVaxPro a Merck, Sharp & Dohme (MSD) gyógyszergyártó hepatitis B elleni vakcinája, amely valójában 2001-ben került engedélyeztetésre az Európai Unióban, az EMA szerint (archiválva itt). Magyarország Nemzeti Népegészségügyi Központja azt követeli, hogy minden hetedik osztályos gyerek be legyen oltva ezzel a szerrel a 2024-2025-ös tanévben (itt archiválva).
Az EMA egyik szóvivője egy 2024. november 13-án a Lead Storiesnak küldött emailben elmagyarázta, hogy a hatóság 2001-ben klinikai kísérleti kört nem tartott szükségesnek, mert a készítmény gyakorlatilag ugyanaz, mint az akkoriban Sanofi Pasteur MSD néven futó cég már jóváhagyott oltása. A régebbi oltás, amelyet csak HBVaxnak hívtak, már a 80-as években használatban volt. Így az Európai Unió tagországainak egészségügyi hatóságai hagyták jóvá, nem az EMA - hozzátette a szóvivő. (Az EMA-t csak 1995-ben állapították (archiválva itt)).
Az egyetlen érdemi különbség a HBVax és a HBVaxPro között az volt, hogy a HBVaxPro nem tartalmazza a thimerosal tartósítószert, amely aggályokat vetett fel a higany tartalma miatt, az EMA honlapja szerint (archiválva itt). Az EMA fokozatosan kezdeményezte a thimerosal leváltását vakcinákban 1999-től, annak ellenére, hogy "a gyógyszerkészítmény dózisonkénti etil-higany szintje nem tekinthető kockázatosnak" (a Lead Stories fordításában angolról, itt archiválva).
A szóvivő kiemelte (fordítás):
Mivel a HBVaxPro-ban használt hatóanyagot az EU-ban már engedélyezték, az első forgalomba hozatali engedély iránti kérelem során nem nyújtottak be hivatalos vizsgálatokat a HBVaxPro-val kapcsolatban. A vállalat információkat szolgáltatott más, thimerosallal rendelkező és nem rendelkező vakcinák összehasonlításáról, beleértve egy a HBVaxPro-val azonos hatóanyagot tartalmazó vakcina vizsgálatait is. A bemutatott vizsgálatok eredményei azt mutatták, hogy a thimerosal-mentes vakcinák hasonló mértékben termelték a hepatitis B vírus elleni antitestek védőszintjeit, mint a thimerosalt tartalmazó vakcinák az oltási kúra végén. Ez magában foglalta azokat a vakcinákat, amelyek a HBVaxPro-val azonos hatóanyagot tartalmaznak.
Az EMA itt foglalta össze az HBVaxPro biztonságosságát igazoló vizsgálatokat (archiválva itt), mondván:
A preklinikai adatok elegendőnek tekinthetők. A [más vakcinákra készült] vizsgálatok adatai extrapolálhatók a monovalens, thimerosal-mentes hepatitis B vakcinára. A különálló vizsgálatok nem szolgáltatnának új ismereteket a HBVAXPRO preklinikai biztonságossági profiljáról.
Orvosi szakértők szerint a thimerosal eltávolítása nem befolyásolja egy oltóanyag biztonságosságát, hatékonyságát. A Lead Stories megkereste Deborah Fullert, az amerikai Washingtoni Egyetem mikrobiológia-professzorát, aki egy 2024. december 4-én küldött emailben a következőt írta:
A közzétett adatok nem mutatnak szignifikáns eltérést az immunogenitásban vagy hatékonyságban, illetve nemkívánatos eseményeket tekintve a thimerosallal vagy anélkül.
Az 1970-es évekre jobb gyártási és adagolási eljárásokat alkalmaztak, a thimerosal iránti igényt csökkentve az oltások biztonsága érdekében, és néhány országban (például Svédországban, Dániában) már thimerosal-mentes vakcinákat használtak anélkül, hogy a hatásosságuk vagy a biztonságosságuk észrevehetően romlott volna. 1999-re ezt már tudhatták, vélhetően megbizonyosodtak arról, hogy a thimerosal eltávolítása nem befolyásolja a vakcinákat.
Fuller egy 2015-ben készült tanulmányra utalt, amely a Hepavax-Gene nevű hepatitis B elleni vakcinának a thimerosal és thimerosal nélküli verzióit hasonlította össze (itt archiválva). A következtetése az volt, hogy (fordítás):
A Hepavax-Gene thimerosal-mentes készítménye immunogenitás tekintetében nem volt rosszabb, mint a Hepavax-Gene thimerosal tartalmú készítménye. Bizonyíték volt arra, hogy a thimerosal-mentes vakcina kevesebb helyi nemkívánatos eseményt okozott.
A Lead Storiesnak nem sikerült megtalálnia a 80-as években az európai nemzeti egészségügyi hatóságok által az HBVax-ra végzett vizsgálatokat a weben. Azonban megtaláltuk az amerikai Élelmiszer- és Gyógyszerügyi Hivatal (FDA) egyik vakcinákkal foglalkozó bizottságának szakvéleményét az oltásról, amely 1986. április 3-án került publikálásra (lásd a 128. oldalt, itt archiválva). Az engedélyeztetési kérelmet az MSD amerikai ága, a Merck & Co. nyújtotta be, a gyógyszer amerikai megnevezését, a Recombivax HB-t használva. A bizottság tagjai megvizsgálták a klinikai kísérletek eredményeit, és megjegyezték (fordítás):
A Merck jelentése szerint minden eredmény pozitív volt: a Recombivax HB biztonságos és immunogén volt laboratóriumi állatokban; védelmet nyújtott a csimpánzoknak; biztonságos és immunogén emberekben (felnőttek); valamint biztonságos és védelmet nyújtott az újszülötteknek.
Az FDA jóváhagyta a Recombivax HB thimerosal-mentes verzióját 1999 augusztusában (itt archiválva).
A Lead Stories további tényellenőrzései a vakcinákról szóló állításokról itt olvashatók.